应同写意邀请,楷拓生物联合创始人、总经理任科云在“2022新型生物药先进技术峰会”上做了《基因治疗大规模质粒工艺开发策略》的报告,本文系根据报告内容整理。
基因治疗是由含有工程化基因构造的载体或递送系统组成,其活性成分包括DNA或RNA,以及基因改造的病毒、细菌或细胞,通过将外源的基因导入靶细胞或者组织,进行替代、补偿、阻断或者修正特定基因,达到治疗疾病的目的。广义上讲,基因治疗是在基因层面操作,以治疗疾病的所有疗法,主要分为体内和体外两种方式。
基因治疗在后疫情时代飞速发展,其研发管线,在国内和国际上都呈现飞速增长的态势,包括国内外细胞基因治疗(CGT)领域的投融资和BD合作。
1、何谓质粒DNA
质粒DNA能够广泛用于基因细胞治疗和核酸药物领域。
什么是质粒:细菌的除大部分集中于核质染色体内,尚有少部分存在于染色体外,称为质粒,是一种独立于染色体外,能够进行自主复制的细胞质遗传因子。
质粒的结构与功能:存在于原核生物、真菌和少数植物细胞中,是一种核外遗传物质,但不是细胞生存所必需的;有自己的复制起始序列,独立于核DNA进行复制,有独立的复制系统;质粒DNA含有少量编码蛋白的基因,这些基因对宿主细胞的生存影响不大,但能改变细胞的某些性状,如抗性、降解有机物的酶等;质粒是分子生物学中最常见的克隆载体。
一般特性:多数质粒是双链超螺旋结构闭合环状,少数线性;质粒具有可转移性,如F质粒;可整合性;(整合、重组)、拷贝数(严紧型、松弛型)
大肠杆菌细胞、抗菌素抗性基因、控制质粒DNA转移的基因
大肠杆菌质粒的分子结构示意图
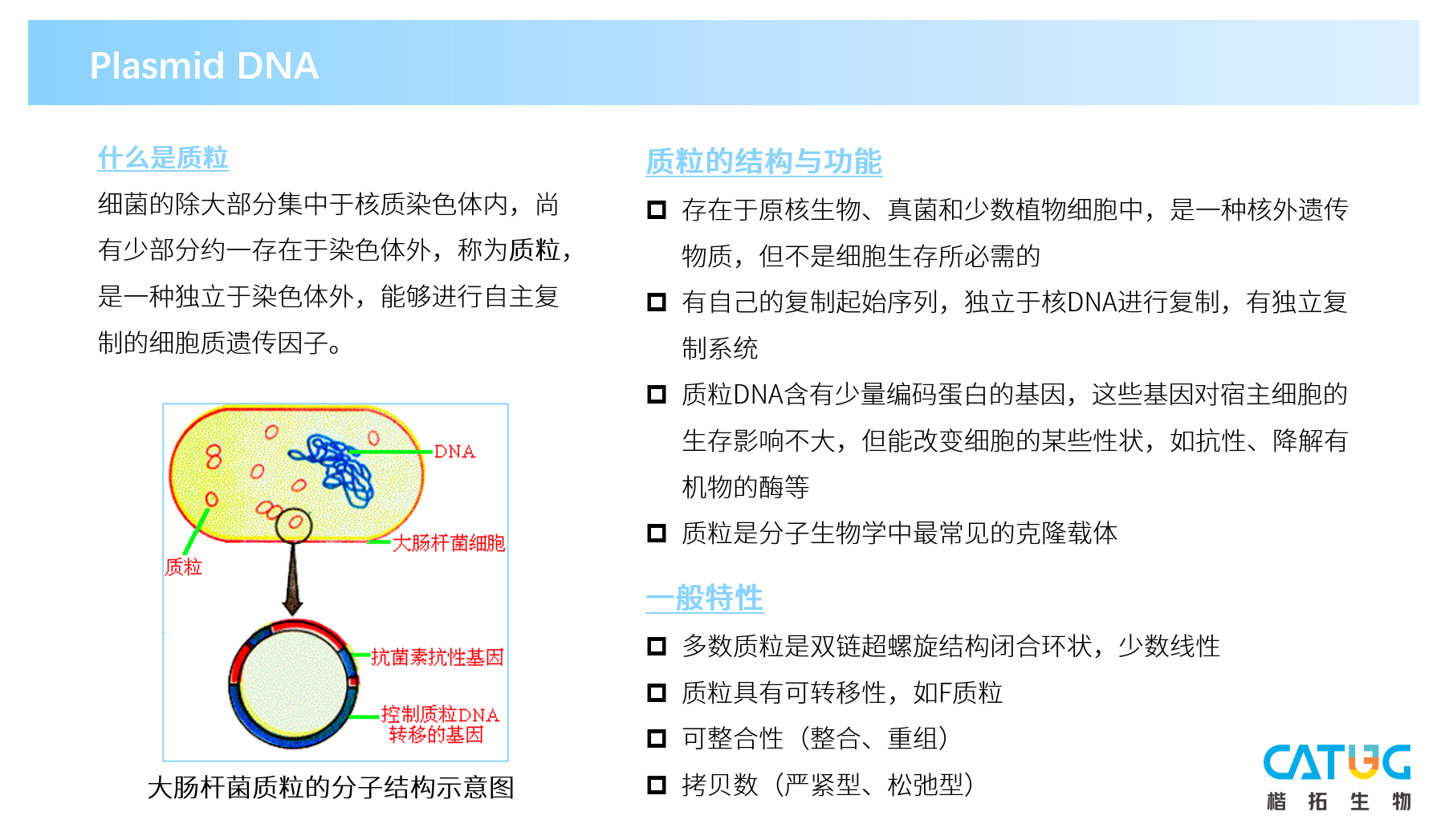
如图所示,质粒包裹在宿主菌/大肠杆菌中,中间的一小部分就是质粒DNA。
从结构上看,质粒是存在于细胞质中的一类独立于染色体的自主复制的遗传成分。除了酵母的杀伤质粒是RNA质粒外,迄今为止所有的质粒无一例外都是属于这种类型的DNA分子。质粒DNA分子可以持续稳定地处于染色体外的游离状态,随着染色体的复制而复制,并通过细胞分裂传递到后代。
为了更好地适应细胞的生理特点,质粒主要以细长并具有负超螺旋结构的形式存在于原核细胞中。环形双链的质粒DNA分子具有三种不同的构型:超螺旋质粒DNA;开环质粒DNA和线性质粒DNA分子。
质粒DNA大部分都是双链超螺旋的闭合环状,少数是线性化的,且具有可转移性、可整合性,以及拷贝数,后者分为松弛型和严紧型两种状态。
质粒工艺开发策略
常见的质粒工艺的主要流程包括载体构建、发酵培养、碱裂解、澄清/浓缩、RNA层析、SC DNA层析、精纯,以及浓缩置换。
载体构建
载体构建主要分为四部分:复制原点的选择、抗性基因的选择、调控序列的选择以及目的基因的选择。
首先是复制起点的选择。为了提高质粒DNA的产量,通常会选择含Col EI复制原点的高拷贝质粒。携带ColE1复制子的质粒中,RNA II复制是正向的调节分子,RNA I是复制的负调节物。同时,质粒编码的一种Rop/Rom蛋白蛋白可以调节RNA I和RNA II的结合效率,起到增强RNA负调控的作用。我们发现,Rop/Rom基因缺失至少可使colE1质粒拷贝数提高3至4倍。
其次是抗性基因的选择。在选择抗性基因时,由于极少量即可引起部分人群强烈的过敏反应,首先应避免β-内酰胺类抗生素的使用。
在调控序列部分,构建质粒DNA需要考虑控制目的基因在真核细胞中高效和稳定表达的启动子和终止信号等的调控序列。
最后是目的基因的选择。在选择和构建质粒DNA时,首先应考虑的是质粒DNA可否整合入宿主基因组,因此,在选择目的基因时,须严格避免目的基因同人类基因组之间具有长片断的同源序列;启动子和终止子同样须认真筛选以严格控制其生物学活性。构建质粒DNA的过程必须有详细的记录,包括目的基因的序列,以及宿主菌的表型和基因型鉴定。
发酵工艺/控制优化
提高质粒DNA稳定性方法主要有四种,第一是改进载体宿主系统,包括高表达和稳定性。第二是施加选择压力,第三是控制外源基因过量表达,过量表达可能也会导致基因丢失和不稳定。第四是优化培养条件。
发酵主要是在培养基、培养方式、营养物质、溶氧、pH、温度、代谢产物这几个方面进行优化。大肠杆菌可以在营养丰富或贫乏的培养基中生长,但是营养物的种类及来源对质粒DNA的质量和数量都产生重大影响。
控制细菌较低生长速率,对质粒的复制有很大的好处,宿主菌过快的直接后果是质粒复制跟不上细菌的生长,导致拷贝数下降或者质粒丢失。
裂解工艺
质粒工艺开发最关键的工艺是裂解工艺,它利用溶胞后核酸从胞内释放,利用质粒和染色体DNA变性和复性特点上的差异将质粒和染色体DNA分离开;在强碱性环境中氢键断裂,DNA双链解开成单链变性,随后用酸性缓冲液调至中性,变性质粒迅速复性,溶解于溶液环境中,而染色体DNA不能迅速复性。
最经典裂解工艺还是碱裂解。

名称 溶液配方
工序 溶液 葡萄糖 重悬 氢氧化钠 裂解 醋酸钾 中和
溶液I中,EDTA是最重要的主成分,它可以螯合细胞膜和骨架上面的钙离子、镁离子,同时能够使细胞更易破碎。EDTA在螯合镁离子时,可以使内源性的DNase因缺失镁离子而无法发挥作用,同时保持DNA的稳定性。
溶液I中会加入Tris溶液,后者主要起着缓冲pH值的作用,葡萄糖起着缓冲防止gDNA断裂的作用。
溶液II是非常关键的一部分,它的作用主要是破裂整个细胞。SDS能够破坏细胞膜,释放菌体的内容物。
与此同时,绝大多数蛋白质和脂肪都在进行变性的溶解。氢氧化钠可以使DNA和基因组的DNA变性,而质粒DNA由于特有的拓扑超螺旋结构,在下一步自然的复性中能够回复。而基因组的DNA却永久变性。
溶液III是中和。整个溶液需要保持非常均匀的状态,防止局部pH值过高,导致无法进行DNA不可逆的回复作用。
正常情况下,裂解工艺中的裂解效率达到80%以上,后续才能够得到比较好的结果。
连续裂解工艺
这部分裂解的作用主要是质粒的释放和HCD的去除,是整个下游工艺回收和HCD控制最关键、最核心的步骤。但这部分存在裂解效率、HCD去除、工艺稳定和放大可行性四个难点。
楷拓生物技术团队通过专有设计装置实现可产业化放大的连续裂解工艺,并通过优化稀释倍数、裂解比例、裂解时间、中和时间等关键参数,可使连续裂解工艺的裂解效率稳定在90%以上,HCD在粗纯后控制在0.5%的水平,工艺稳定,可行性放大。
TFF工艺
TFF工艺切向流的应用部分,包括菌体收集、裂解澄清,以及浓缩置换。目的是替换传统的离心法和乙醇沉淀法。在大规模质粒放大时,提高工艺可放大性和合规性。其中,材质和孔径、TMP优化和剪切力是比较关键的地方,也是技术难点。
TFF工艺可选择中空纤维膜柱和膜包,而质粒工艺中选择中空纤维膜柱效果会更好,因为中空纤维的剪切力更小。
层析工艺
DNA层析主要分为分辨率、速度、载量,以及回收率四部分。
目前国内也有在使用两步层析法,其实就是用氯化钙等替代替了比较经典的6FF工艺,原理基本是一样的,主要目的还是去除RNA。
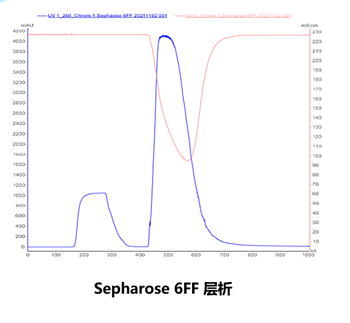
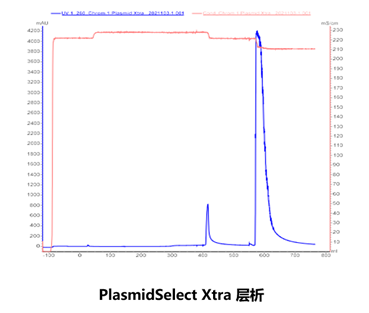
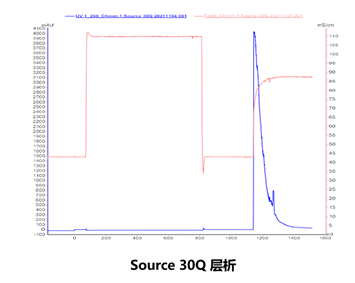
层析
如图所示,第一步Sepharose 6FF纯化后,样品中基本无RNA残留。DNA超螺旋正常会在80%左右。第二步是Xtra,这一步最主要的作用是去除开环的超螺旋。去除效率最高可达15%以上,纯化后的超螺旋状态一般会达到95%以上。最后一步主要是去除杂质,比如HCD的残留在这一步可以达到0.1%以下。
质粒菌种构建工艺
质粒载体构建和宿主菌的选择,会对产率和质量产生影响,对后期的生产工艺也会有很大影响,包括质粒传代的稳定性、传代稳定性中不同的表达状态,以及菌种的安全性,也就是明确不能使用氨苄青霉素抗性。
整个过程为:质粒构建—质粒转化—克隆筛选—RCB建库—菌种培养—MCB建库—菌种培养—WCB建库—检定放行。
其中菌种质量的控制,主要是菌种特性、质粒相关特性和质粒鉴定三方面,不同的选择在RCB、MCB和WCB中有一定差别。
当前质粒的拓扑结构分析方法主要有HPLC、CE、AGE法三种,其中AGE法应用广泛,但其存在一定弊端。而已公开的HPLC和CE方法常见适用于5kb及以下小质粒。
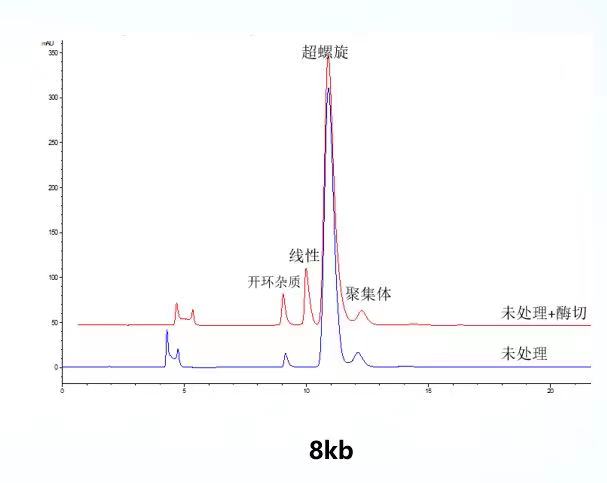
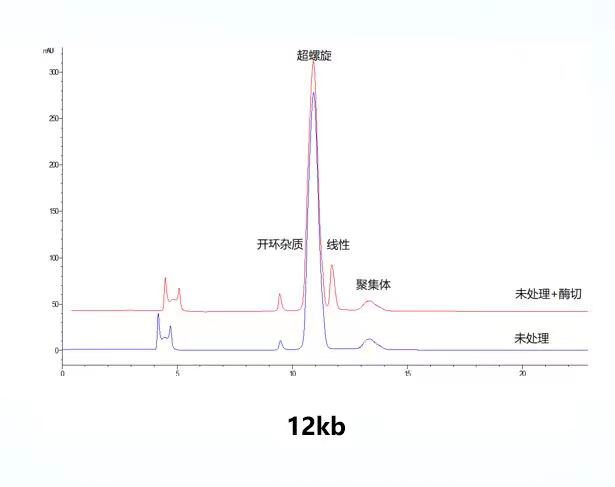
楷拓生物质粒平台已建立了适用于AAV及慢病毒包装相关的7-12kb的质粒的超螺旋比例HPLC检测方法。平台分析方法能对7-12kb质粒的超螺旋、线性、开环、聚集体峰进行分离,如左、右图示分为8kb、12kb质粒图谱。
线性化质粒工艺开发策略
线性化质粒工艺开发,其实就是在超螺旋的质粒后加入酶切,再进行纯化和置换。线性化的质粒分析就是比超螺旋质粒更简单,基本上在酶促反应之后,去除一些杂质。一般线性化质粒都可以达到98%或者99%以上的水准。目前线性化DNA质量的控制,也是分为研究级别、临床GMP级别和GMP级别。
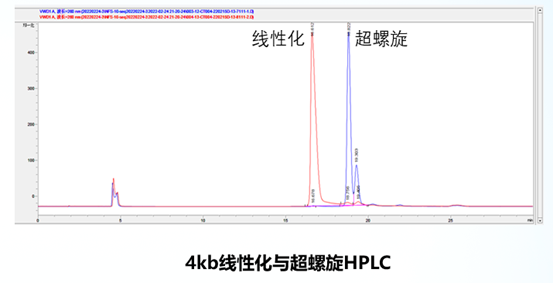
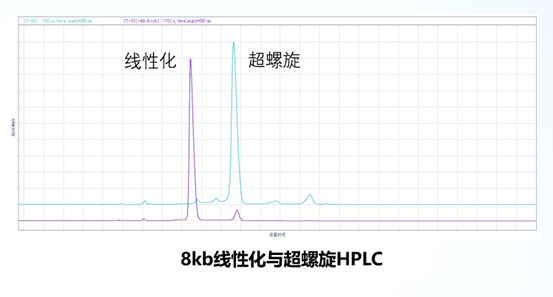
如图所示,前面是在超螺旋状态下检测的峰型,后面是在酶促反应线性化的情况。将线性化的4~8KBmRNA疫苗的线性化质粒进行重叠,会发现重叠性很高。
每个质粒开发的方法各不相同,不同的大小、不同的载体、不同的片段在工艺上的体现也是截然不同的。面对不同的需求,楷拓生物质粒平台可以针对每个质粒的用途和特殊性去开发专属性的工艺,提供高效、灵活、可定制的专业服务。